Antwort Wie stark sind Van-der-Waals-Kräfte? Weitere Antworten – Sind Van-der-Waals-Kräfte stark
Van-der-Waals-Kräfte sind schwache Anziehungskräfte zwischen Molekülen, die aufgrund von spontaner Polarisation der Atome und Moleküle auftreten.Wasserstoffbrücken sind die stärksten zwischenmolekularen Wechselwirkungen. Sie werden auch Wasserstoffbrückenbindungen genannt, sind jedoch keine chemischen Bindungen.Aufgrund ihrer Stärke unterscheidet man drei Typen zwischenmolekularer Kräfte: Wasserstoff-Brücken-Bindung – Dipol-Dipol-Wechselwirkung – Van-der-Waals-Kraft Eine Wasserstoffbrücke ist stärker als eine Dipol-Dipol-Wechselwirkung, welche wiederum die Stärke einer Van-der-Waals-Kraft übertrifft.
Welche zwischenmolekularen Kräfte sind am stärksten : Wasserstoffbrückenbindungen. Wasserstoffbrückenbindungen stellen zwischenmolekulare Wechselwirkungen zwischen einem positiv polarisierten Wasserstoffatom und einem freien Elektronenpaar dar. Es handelt sich hierbei um die stärksten zwischenmolekularen Wechselwirkungen.
Wann sind die Van-der-Waals-Kräfte am stärksten
Je länger die Kette der Kohlenstoffatome ist, desto größer ist dementsprechend die Berührungsfläche zwischen den Molekülen. Je größer die Berührungsfläche, desto stärker sind die van der Waals Kräfte.
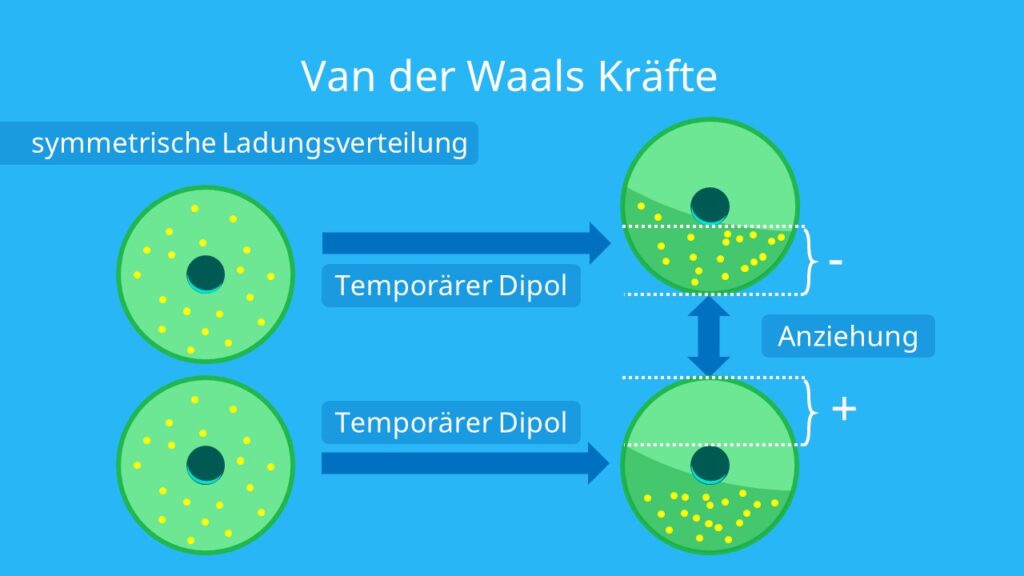
Wann werden Van-der-Waals-Kräfte stärker : Die Van-der-Waals-Kräfte sind für viele Eigenschaften von Molekülen verantwortlich. Solche Moleküle sind vor allem Kohlenwasserstoffe, wie zum Beispiel Alkane. Je länger ein Molekül ist, desto mehr temporäre Dipole kann dieses ausbilden. Dadurch treten auch mehr, also stärkere, VdW-Kräfte zwischen den Molekülen auf.
Die Dipol-Dipol-Wechselwirkungen sind stärker als die reinen Van-der-Waals-Kräfte, allerdings schwächer als die Wasserstoffbrückenbindungen.
Die schwache Wechselwirkung wirkt zwischen allen (linkshändigen) Quarks und (linkshändigen) Leptonen. Sie ist 1011 mal schwächer als die starke Wechselwirkung. Wie diese und die elektromagnetische Wechselwirkung wird sie durch den Austausch von Eichbosonen beschrieben.
Welche ZMK sind am stärksten
Die Wasserstoffbrücken sind die stärksten der drei zwischenmolekularen Kräfte bei Molekülen.Die Dipol-Dipol-Wechselwirkungen sind stärker als die reinen Van-der-Waals-Kräfte, allerdings schwächer als die Wasserstoffbrückenbindungen.Van-der-Waals-Kräfte
- die zur absoluten Temperatur indirekt proportionale Keesom-Wechselwirkung zwischen zwei Dipolen (Dipol-Dipol-Kräfte),
- Debye-Wechselwirkung zwischen einem Dipol und einem polarisierbaren Molekül (Dipol-induzierter-Dipol-Kräfte)
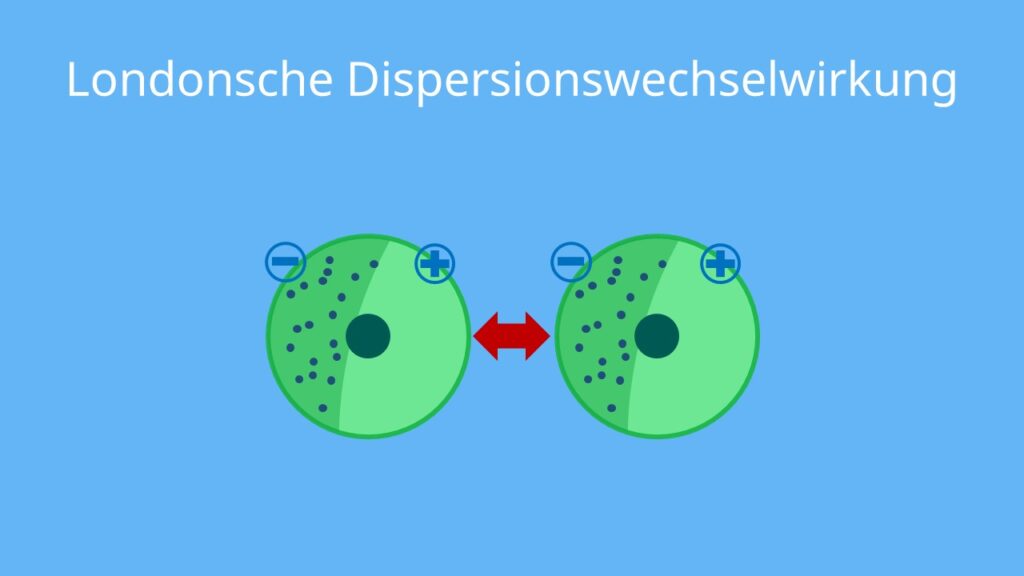
Die London-Kräfte werden oft auch als Van-der-Waals-Kraft im engeren Sinne bezeichnet.
Sind Dipol Dipol Kräfte stark : Dipol-Dipol-Wechselwirkungen zählen zu den stärksten Van-der-Waals-Kräften und somit auch zu den zwischenmolekularen Wechselwirkungen. Insgesamt sind sie deutlich schwächer als die kovalente Bindung, die Metallbindung und die Ionenbindung.
Was ist stärker Dipol Dipol oder Wasserstoffbrücken : Die Dipol-Dipol-Wechselwirkungen sind stärker als die reinen Van-der-Waals-Kräfte, allerdings schwächer als die Wasserstoffbrückenbindungen.
Was sind starke und schwache Wechselwirkung
Die starke Wechselwirkung wird von der sog. Farbladung bestimmt und Botenteilchen der starken Wechselwirkung sind die Gluonen. Der schwachen Wechselwirkung unterliegen nur Teilchen mit schwacher Ladung.
Während die starke Kraft dafür verantwortlich ist, dass die Quarks zu Protonen und Neutronen gebunden werden (und ebenfalls, dass die Protonen und Neutronen eines Atomkerns gebunden werden), manifestiert sich die schwache Wechselwirkung in unserer Alltagswelt nur in speziellen Formen der Radioaktivität.Der Grund dafür sind Wasserstoffbrückenbindungen. Bei Wasserstoffbrückenbindungen kommt es zu einer Anziehung zwischen einem Wasserstoffatom, welches an ein Molekül gebunden ist, und einem freien Elektronenpaar eines anderen Moleküls. Es handelt sich dabei um die stärksten zwischenmolekularen Wechselwirkungen.
Wie wirken Van-der-Waals-Kräfte : Van-der-Waals-Kräfte (kurz VdW-Kräfte) sind keine echten Bindungen, sondern nur Anziehungskräfte. Diese wirken zwischen allen Teilchen, die keine permanenten Dipole aufweisen. VdW-Kräfte sind nur sehr schwach und werden deshalb oft von anderen Kräften und Bindungen übertrumpft.